Vaccine ngừa COVID-19 ‘made in’ Việt Nam được phép thử nghiệm lâm sàng giai đoạn 3
Ngày 7/8, Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia (HĐĐĐQG) đã tổ chức họp khẩn để nghiệm thu kết quả thủ nghiệm lâm sàng giai đoạn 1 vaccine Nanocovax do Việt Nam sản xuất.
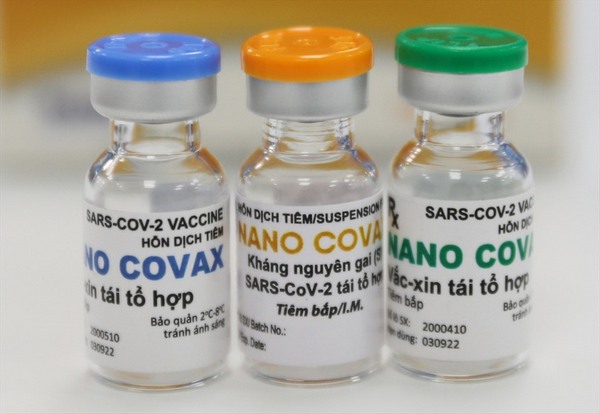
Tại cuộc họp này, HĐĐĐQG đã thống nhất nghiệm thu kết quả thứ nghiệm lâm sàng (TNLS) giai đoạn 1 vắc xin Nanocovax với dữ liệu theo dõi đến tháng thứ 6 kể từ liều tiêm đầu tiên của giai đoạn 1 trên 60 người tình nguyện với 3 mức liều 25 mcg, 50 mcg, 75 mcg. Trên cơ sở cập nhật kết quả đánh giá giữa kỳ giai đoạn 2 đến thời điểm hiện tại, HĐĐĐQG quyết định tiếp tục cho phép triển khai TNLS giai đoạn 3 với mức liều 25mcg theo đề cương nghiên cứu đã được phê duyệt.
Căn cứ tài liệu, hồ sơ các tổ chức nhận thử (Học viện Quân Y và Viện Pasteur, TP.HCM), Công ty Cổ phần công nghệ sinh học dược Nanogen gửi ngày 03/8/2021, HĐĐĐQG đã tổ chức cuộc họp khẩn cấp để nghiệm thu kết quả thử nghiệm lâm sàng (TNLS) giai đoạn 1, đánh giá kết quả giữa kỳ TNLS giai đoạn 2 đến thời điểm hiện tại và ghi nhận tiến độ triển khai TNLS giai đoạn 3a (giai đoạn đầu của giai đoạn 3, hiện chưa có báo cáo kết quả chính thức).
Theo đánh giá của HĐĐĐQG: kết quả TNLS giai đoạn 1, 2 vaccine Nanocovax đánh giá bước đầu tính an toàn, khả năng dung nạp và thăm dò đáp ứng sinh miễn dịch của vaccine nghiên cứu, chưa đánh giá hiệu lực bảo vệ của vaccine. Đánh giá kết quả giữa kỳ giai đoạn 2 là đánh giá trong ngắn hạn tính an toàn và tính sinh miễn dịch của vaccine nghiên cứu để xác định liều dùng tối ưu của vaccine trong TNLS giai đoạn 3.
Theo đề cương nghiên cứu TNLS giai đoạn 2 kéo dài đến tháng 02/2022, tuy nhiên, nhằm đẩy nhanh tiến độ phát triển vaccine, HĐĐĐQG đã họp khẩn cấp để đánh giá kết quả giữa kỳ TNLS giai đoạn 2 và cho phép thực hiện TNLS giai đoạn 3 trong khi vẫn tiếp tục hoàn thiện hồ sơ đánh giá giữa kỳ giai đoạn 2 và tiếp tục triển khai giai đoạn 2 theo đề cương được duyệt. Đối với TNLS giai đoạn 3, để sớm có kết quả về tính sinh miễn dịch HĐĐĐQG cho phép chỉ thực hiện các xét nghiệm về tính sinh miễn dịch ở giai đoạn 3a trên 1.000 người tình nguyện.
Phát biểu tại cuộc họp, Thứ trưởng Bộ Y tế Trần Văn Thuấn đồng ý về việc cần thành lập ngay Tổ hỗ trợ, phân tích, đánh giá, giám sát số liệu và quy trình của 2 đơn vị tham gia nghiên cứu thử nghiệm lâm sàng, và đề nghị phải có báo cáo trước ngày 14/8/2021.
Thứ trưởng cũng yêu cầu các đơn vị nhận TNLS là Học viện Quân y, Viện Pasteur Thành phố Hồ Chí Minh và đơn vị độc lập là Viện Vệ sinh dịch tễ Trung ương kết hợp với nhà sản xuất là Công ty Cổ phần công nghệ sinh học dược Nanogen khẩn trương hoàn thiện báo cáo pha 3a gửi cho Hội đồng và Cục Khoa học Công nghệ và Đào tạo.Trên cơ sở đó, kết hợp với kết quả của Tổ công tác, đề nghị Hội đồng tiếp tục họp vào ngày 15/8/2021 để đánh giá kết quả giai đoạn 3a, đưa ra khuyến nghị các biện pháp khẩn thiết, cần thiết.
“Tại cuôc họp hôm nay, với đầy đủ các cơ quan nghiên cứu, Bộ Y tế đề nghị cân nhắc xem xét có tiến hành nghiên cứu bổ sung về việc tiêm mũi 3 vaccine Nanocovax hay không, bên cạnh đó xem xét bổ sung các chủng mới của vi-rút Corona (như chủng Delta) vào nghiên cứu ở thời điểm thích hợp.
Đề nghị Cục Khoa học Công nghệ và Đào tạo có công văn trả lời các tỉnh có Công văn gửi Chính phủ, Bộ Y tế xin phép tiêm thử vaccine Nanocovax, trong đó thể hiện rõ quan điểm của Bộ Y tế rất ủng hộ, tạo mọi điều kiện để các tỉnh tham gia thử nghiệm lâm sàng, tuy nhiên phải tuân thủ đúng theo các quy trình, quy định về thử nghiệm lâm sàng. Bộ Y tế rất không đồng ý việc lợi dụng ưu tiên thử nghiệm lâm sàng vào mục đích thương mại”, Thứ trưởng Thuấn nhấn mạnh.
- Cùng chuyên mục
'Nhà nước được trưng mua, trưng dụng tài sản tổ chức, cá nhân cho tình trạng khẩn cấp về thiên tai'
Trước tình trạng khẩn cấp do thiên tai gây ra tại miền Trung, chính quyền được trưng mua, trưng dụng tài sản tổ chức, cá nhân theo quy định của pháp luật.
Sự kiện - 27/11/2025 14:24
Vì sao người Bắc lại chuộng bất động sản trung tâm TP.HCM?
Theo chuyên gia, cơ hội đầu tư bất động sản trung tâm TP.HCM vẫn tốt. Thời điểm hiện tại, so với Hà Nội, bất động sản trung tâm TP.HCM có giá ngang bằng hoặc thấp hơn, thậm chí, bất động sản ngoài vành đai đang rẻ hơn Hà Nội rất nhiều.
Sự kiện - 27/11/2025 07:53
Hà Nội thí điểm cấm xe chạy xăng, dầu vào vành đai 1 theo giờ từ 1/7/2026
Từ ngày 1/7/2026, Hà Nội thí điểm cấm theo giờ một số phương tiện chạy xăng dầu đi vào 9 phường trong vành đai 1 nhằm giảm phát thải, cải thiện chất lượng không khí.
Sự kiện - 27/11/2025 07:50
Trả gộp 3 tháng lương hưu, trợ cấp bảo hiểm cho người thụ hưởng ở 4 tỉnh bị ảnh hưởng lũ lụt
Bảo hiểm Xã hội Việt Nam sẽ chi trả gộp 3 tháng lương hưu và trợ cấp bảo hiểm xã hội (tháng 12/2025, tháng 1/2026 và tháng 2/2026) cho người dân 4 tỉnh Đắk Lắk, Gia Lai, Khánh Hòa, Lâm Đồng đang chịu hậu quả nặng nề của thiên tai, vào kỳ chi trả cuối cùng của năm 2025,
Sự kiện - 26/11/2025 17:05
Hà Nội đẩy mạnh khởi công các khu công nghiệp mới, thu hút đầu tư năm 2025 có thể đạt 710 triệu USD
Ban Quản lý các Khu công nghệ cao và Khu công nghiệp TP. Hà Nội cho biết, từ nay đến cuối năm sẽ tham mưu UBND TP. Hà Nội đẩy mạnh khởi công các khu công nghiệp mới. Dự kiến năm nay, tổng vốn đăng ký đầu tư có thể đạt 710 triệu USD, vượt 134% kế hoạch đề ra.
Sự kiện - 26/11/2025 15:18
'Ông lớn' FDI tại Khánh Hòa chi hàng tỷ đồng hỗ trợ khẩn cấp sau mưa lũ lịch sử
Công ty TNHH Đóng tàu HD Hyundai Việt Nam triển khai gói hỗ trợ khẩn cấp hàng tỷ đồng nhằm giúp công nhân ổn định cuộc sống và chung tay cùng Khánh Hòa khắc phục hậu quả thiên tai.
Sự kiện - 26/11/2025 14:29
[Gặp gỡ thứ Tư] 'Bất động sản TP.HCM hấp dẫn nhà đầu tư khi có Trung tâm Tài chính quốc tế'
"TP.HCM khi có Trung tâm Tài chính quốc tế sẽ hình thành cộng đồng cư dân tinh hoa là các doanh nhân, chuyên gia đến từ toàn cầu. Điều này rất hấp dẫn cho các nhà đầu tư bất động sản", TS-KTS Trương Văn Quảng nhận định.
Sự kiện - 26/11/2025 12:34
VAFIE và Thuế tỉnh Hưng Yên đồng hành cùng người nộp thuế
Ông Nguyễn Đức Sơn, Trưởng Thuế tỉnh Hưng Yên khẳng định tinh thần đồng hành với người nộp thuế hướng tới nuôi dưỡng nguồn thu một cách thực chất và bền vững, lắng nghe những khó khăn, vướng mắc của doanh nghiệp trong quá trình thực thi pháp luật Thuế
Sự kiện - 26/11/2025 08:53
Thủ tướng: Phát huy tinh thần '3 cùng' thúc đẩy hợp tác Việt - Nhật
Dự Diễn đàn Hợp tác địa phương Việt Nam - Nhật Bản lần thứ nhất, Thủ tướng Phạm Minh Chính khẳng định sẽ phát huy tinh thần "3 thông" để cải thiện môi trường đầu tư kinh doanh của Việt Nam và luôn đồng hành cùng các địa phương, nhà đầu tư Nhật Bản theo tinh thần "3 cùng".
Sự kiện - 26/11/2025 08:39
Giá trị của bất động sản trung tâm TP.HCM
Bất động sản trung tâm TP.HCM tiếp tục khẳng định giá trị bền vững và ít chịu tác động bởi biến động ngắn hạn của thị trường. Xu hướng tăng trưởng của bất động sản tại khu vực trung tâm vẫn sẽ duy trì trong 3-5 năm tới.
Sự kiện - 25/11/2025 09:11
VAFIE tổ chức Hội thảo Thuế tại Hưng Yên
Ngày 25/11, VAFIE sẽ phối hợp với cơ quan Thuế tỉnh Hưng Yên tổ chức Hội thảo với chủ đề: Cập nhật chính sách thuế Doanh nghiệp và một số lưu ý về quyết toán thuế TNDN 2025.
Sự kiện - 25/11/2025 07:37
'Các nền tảng số trích dẫn nội dung báo chí phải chia sẻ doanh thu với báo chí'
Đại biểu Quốc hội đề nghị bổ sung quy định về quyền liên quan của cơ quan báo chí trên không gian mạng, bảo vệ quyền sở hữu trí tuệ và quyền lợi kinh tế của các cơ quan báo chí đã đầu tư chi phí lớn để sản xuất thông tin chính xác, có kiểm chứng.
Sự kiện - 25/11/2025 06:45
Vingroup hỗ trợ khẩn cấp 500 tỷ cho các tỉnh miền Trung
Tập đoàn Vingroup kích hoạt gói hỗ trợ 500 tỷ đồng thứ 2 cho công tác cứu trợ và khắc phục hậu quả thiên tai tại các tỉnh miền Trung, nâng tổng mức đóng góp lên 1.000 tỷ đồng.
Sự kiện - 24/11/2025 18:22
TP.HCM chia sẻ khó khăn với người dân vùng lũ Khánh Hòa
Ngoài kinh phí 50 tỷ đồng mà TP.HCM hỗ trợ tỉnh Khánh Hòa, thành phố còn hỗ trợ 4 bếp ăn cung cấp 24.000 suất/ngày, 50.000 túi quà thiết yếu, 10.000 túi thuốc gia đình, 10.000 áo phao, 150 tấn hàng hóa; bố trí 30-50 bác sĩ hỗ trợ khám chữa bệnh.
Sự kiện - 24/11/2025 14:34
'Sở hữu trí tuệ phải trở thành tài sản của doanh nghiệp'
Sở hữu trí tuệ phải trở thành tài sản của doanh nghiệp, có thể định giá, mua bán, được đưa vào báo cáo tài chính, có thể là tài sản đảm bảo để đi vay góp vốn, nhất là tài sản công nghệ mới, công nghệ số.
Sự kiện - 24/11/2025 14:23
Giãn, hoãn nợ, miễn, giảm lãi suất với cá nhân, doanh nghiệp bị thiệt hại do mưa, lũ
Thủ tướng Chính phủ vừa ký công điện yêu cầu các bộ ngành, địa phương khắc phục hậu quả mưa lũ, khôi phục sản xuất, ổn định đời sống nhân dân tại Nam Trung Bộ.
Sự kiện - 24/11/2025 09:06
- Đọc nhiều
-
1
HSC: VinMetal có thể mua lại Pomina
-
2
Cổ phiếu xuất khẩu: Nhóm ngành đang bị thị trường 'bỏ quên'?
-
3
Hơn 8.000 nhà đầu tư 'sập bẫy' đường dây lừa đảo tiền ảo TOSI
-
4
Cổ phiếu CTX lao dốc sau tin rời sàn, ai bảo vệ nhà đầu tư nhỏ lẻ?
-
5
Đà Nẵng chấn chỉnh tình trạng 'cò mồi' tại các dự án nhà ở xã hội
Đáng đọc
- Đáng đọc
Gần 1 tỷ USD trái phiếu 'chảy về' một Group
Tài chính - Update 1 month ago
'Cơn sốt' vàng bao giờ chấm dứt?
Thị trường - 1 month
Nhóm vật liệu xây dựng nào sẽ phục hồi rõ nét hơn dịp cuối năm?
Thị trường - Update 1 month ago













![[Gặp gỡ thứ Tư] 'Bất động sản TP.HCM hấp dẫn nhà đầu tư khi có Trung tâm Tài chính quốc tế'](https://t.ex-cdn.com/nhadautu.vn/256w/files/news/2025/11/26/abc-1219.jpg)











